PRIMER PREÁMBULO
Al meditar sobre las últimas técnicas publicadas acerca de la clonación y la manipulación genética de organismos pluricelulares. Técnicas en las que se utilizan virus genéticamente manipulados que, una vez inducida una infección celular, dan lugar a recombinaciones cromosómicas produciendo híbridos artificiales en los que se insertan genes procedentes de seres tan distantes como animales y vegetales, no podemos evitar sentir, junto al sentimiento de asombro y admiración, otro de miedo razonable acerca de las implicaciones que podría tener un descontrol en estos proyectos.
No parece que resulte muy difícil la eliminación de un híbrido artificial fallido, pero la absoluta seguridad de que un virus manipulado, destinado a recombinar genes no pueda accidentalmente infectar un organismo fuera del ámbito experimental científico, no nos parece imposible.
No se podrá evitar, debido a las enormes expectativas económicas que la manipulación genética promete, que estas técnicas continúen.
No obstante, algunos técnicos creemos que la humanidad no tiene por qué abandonar otro camino paralelo mucho más seguro y que tiene probada su utilidad y su seguridad: Domar seres vivos.
La doma lleva implícita una hibridación y una selección, pero también una inducción al desarrollo de una especie en unas condiciones que sin ser las naturales suyas, son las que producen un beneficio esperado a los humanos.
La ventaja de los seres domados es que su naturaleza salvaje les hace muy útiles por las novedades que sus mutaciones e hibridaciones naturales, pueden ofrecernos.
Con el término domar estamos refiriéndonos al proceso de:
- Observación de una característica deseable en una especie vegetal o animal, por su aprovechamiento para los humanos.
- Selección de los individuos con más acusada manifestación de esta característica.
- Mejora de la característica mediante cruzamiento natural planificado.
- Obtención de nuevas especies e híbridos para su aprovechamiento social o industrial.
Mediante estas técnicas la humanidad ha sido capaz de obtener un enorme avance en la agricultura, la ganadería y la industria. No nos parece que se pueda dudar del proceso.
En este trabajo haré mención de algunas técnicas utilizadas para el aprovechamiento de hongos para el beneficio humano.
El tema es demasiado amplio ya que los hongos han tenido a lo largo de la historia un complicado proceso de aprovechamiento:
A) COMO ALIMENTO:
Los hongos pluricelulares comenzaron a recolectarse como alimentos por los humanos, probablemente al observar que otros animales los comían sin problemas, lo que más tarde dio lugar a su cultivo.
B) COMO AGENTES TRANSFORMADORES DE UN ALIMENTO:
Más adelante se observó que se podía aprovechar la transformación que los hongos producen en ciertos alimentos. Del aprovechamiento natural se pasó a las técnicas de inducción del ataque y de la selección de los hongos más adecuados.
Este es un escalón mas tecnificado del proceso. Así se dio lugar a los quesos, encurtidos de frutos, embutidos, pan, y bebidas alcohólicas.
C) COMO AGENTES PRODUCTORES DE PRODUCTOS QUÍMICOS:
Con la evolución de la química se consiguió aislar productos químicos producidos por el metabolismo de los hongos sobre sustratos alimenticios en los que se induce su proliferación.
Fue el caso de selección de hongos para producir medicinas, vitaminas e incluso energía, un estado superior de la domesticación de los hongos.
Debido a mis 40 años de dedicación a la fabricación de cerveza, centraré mi trabajo en las técnicas de domesticación del hongo Saccharomyces uvarum (34/70 Weihenstephan Hefe) para la producción de tan social y medicinal bebida.
SEGUNDO PREÁMBULO: LO PLURICELULAR/LO UNICELULAR. LO MACROSCÓPICO/LO MICROSCÓPICO
No estoy seguro de que sea imprescindible esta aclaración, pero sí que conviene explicar algún matiz antes de entrar en materia.
La comunidad científica necesitó un largo periodo de adaptación antes de reconocer que las leyes que explican el mundo microscópico no son las mismas que lo hacen en el microscópico. Si este tema hubiera sido simple quizás el periodo habría sido más corto. El problema fue y es la frontera entre lo macroscópico y lo microscópico, en la que ninguna de las leyes es exactamente aplicable. A pesar de la existencia de este resbaladizo pavimento, la ciencia continúa avanzando pisando sobre él.
Algo parecido ocurre con lo pluricelular y lo unicelular: Muy lejos de las fronteras las cosas son evidentes pero conforme nos aproximamos desde el mundo de lo pluricelular al mundo de lo unicelular el suelo de torna igualmente inseguro.
En el mundo macroscópico las leyes de Newton predicen con asombrosa precisión el movimiento de los planetas, sin embargo en el mundo microscópico es imposible precisar la posición de un electrón al mismo tiempo que su energía.
De la misma manera que la clasificación de un hongo pluricelular se puede realizar con bastante certeza, resulta muy difícil la clasificación de las poblaciones de hongos unicelulares. El motivo es doble: Por un lado el complicado ciclo de reproducción de algunos hongos que hacen que convivan en una población células haploides y diploides con genomas diferentes. Por otro lado la enorme facilidad con la que se producen mutaciones e hibridaciones en las agrupaciones de hongos unicelulares.
Por este motivo aunque los que tratan con hongos pluricelulares suelen conseguir conocer con elevada precisión el género, especie, raza y variedad del hongo que tienen sobre la mesa, los que trabajamos con hongos unicelulares tenemos que conformarnos con una aproximación en la que llegamos a conocer que un elevado número de células de una población, pertenece a una variedad de una especie.
Cuando intentamos clasificar una sola célula de hongo, la imprecisión se incrementa de una forma inquietante. No obstante el asunto no es relevante para los técnicos aunque sí lo sea para los científicos, ya que a nosotros lo que nos interesa es el resultado que una masa de hongos unicelulares produzca al interaccionar sobre un sustrato.
CERVEZA CON HONGOS:
Dejando de lado el sugerente título que pueda trasladar nuestra imaginación a un suculento plato acompañado de una fresca bebida, queremos referirnos a la fabricación de la cerveza mediante hongos del género Saccharomyces.
Son varias las especies del género que se utilizan para la fabricación de los diferentes tipos de cervezas pero no es éste el motivo de esta publicación y no insistiremos en ello. Todo lo que pueda decirse de las técnicas utilizadas con cada uno de los hongos usados es aplicable a uno solo de ellos: Saccharomyces uvarum.
La técnica de la fabricación de la cerveza industrial, a diferencia de la artesanal, es muy compleja, pero el punto clave es la transformación de un mosto de malta de cebada mediante el metabolismo del hongo seleccionado.
Si realizamos una inoculación de una población purificada de hongo en un mosto y la dejamos que actúe sin control podemos asegurar que el producto resultante no tendrá ningún tipo de aprovechamiento social.
La tendencia natural de los seres vivos es la de asimilar alimentos, utilizar parte de ellos para fabricar energía y otra parte para incrementar su masa, de forma que se culmine con la reproducción tan amplia como el medio permita.
Para que el hongo produzca cerveza es necesario someterlo a unas condiciones inducidas, en las cuales se vea obligado a utilizar vías metabólicas no preferentes. Estas vías metabólicas son lesivas para el hongo y tienen como consecuencia su degeneración a corto plazo. Por este motivo no serían elegidas por el hongo a no ser por la actividad domadora del cervecero.
LA CERVEZA COMO METABOLITO DEL HONGO:
Un mosto de malta de cebada es una infusión producida por la disolución y dispersión de infinidad de especies químicas que se originaron durante el malteo.
El malteo es un complicado proceso realizado por otro organismo vivo: El germen del grano de cebada.
Este germen es sometido por el cervecero a condiciones especiales. Es decir, en un proceso de domado, da lugar a especies químicas que no produciría en cantidad o calidad si sólo se desarrollara bajo la influencia del medio natural. Dicho resumidamente, un germen libre produce una planta de cebada, se reproduce en los granos de la espiga y muere. Por el contrario un germen domado fabrica gran cantidad de especies químicas y después se induce su inhibición sin permitir la reproducción.
Las especies químicas que busca el cervecero son las que necesita para fabricar un mosto que sea lo suficientemente adecuado para que el hongo prolifere en él y lo suficientemente adecuado para que sobre algo que el hongo no pueda transformar. Lo que no puede transformar junto con lo que le obligamos a producir constituye la cerveza.
En la fabricación del mosto, que es un proceso químico, se utilizan las enzimas digestivas que había fabricado de manera natural el germen de cebada, y que se ha cuidado mucho de no desactivar. La tendencia del germen era la de transformar el grano de cebada por vía digestiva para producir energía y órganos que permitan alimentarse de minerales: Raíces y tallo. El cervecero no tiene ningún interés en esta vía metabólica sino que busca una elevada producción de enzimas y una transformación suficiente de almidón y proteínas sin que llegue a desarrollarse la planta. Por eso obliga al germen, bajo condiciones controladas como un domador, a producir lo que normalmente no haría.
Pero la fabricación de la malta no es tampoco el objetivo de esta publicación. Baste con comentar que la malta molida a harina debe de ser mezclada con agua templada.
Es suficiente con que digamos que sencillamente gobernando temperatura, pH y tiempo, se pueden controlar un conjunto de reacciones químicas enzimáticas con la intención de fabricar el mosto adecuado.
Bajo las condiciones adecuadas las proteasas transformarán las proteínas de las capas externas del grano de cebada en aminoácidos, polipéptidos y peptonas. Las amilasas transformarán el almidón del interior del grano en azúcares sencillos y las glucanasas transformarán los glucanos o gomas que protegen los granos de almidón en azúcares sencillos también.
El proceso es bastante más complicado pero esta simplificación es suficiente para comprenderlo.
Una vez obtenido el mosto se acondiciona para seguidamente inocular una dosis de siembra de levadura.
Mediante una pequeña cantidad de oxígeno (unas 8 p.p.m.) que se incorporó al mosto, se induce un periodo asimilativo del hongo en el que se produce una fuerte proliferación. Alrededor de 5 o 6 veces se divide cada célula en términos estadísticos. En este periodo se consumen gran cantidad de azúcares y aminoácidos.
Seguidamente se procede a la fase clave en la fabricación: La fermentación.
En esta fase se gobierna el metabolismo de las células mediante la temperatura, la presión y el tiempo.
Los Saccharomyces son hongos fermentativos alternativos que sólo usan esta vía metabólica en condiciones difíciles.
En condiciones normales se desarrollan por vía asimilativa.
La fermentación, expresada resumidamente, es la transformación de un azúcar para obtener oxígeno cuando éste falta en el medio. Con este oxígeno obtenido se realiza una combustión metabólica de otra molécula de azúcar para obtener energía.
La primera molécula, la que aporta oxígeno, se transforma en alcohol. La segunda molécula produce CO2 y H20.
Es suficiente con advertir que estas dos reacciones se producen a lo largo de ciclos metabólicos complejos pero bien conocidos. Pero no es necesario que los reseñemos aquí.
Sí es interesante hacer notar que ya disponemos de dos componentes importantes de la cerveza: El alcohol y el gas carbónico CO2.
Las citadas condiciones difíciles son inducidas por el cervecero manipulando artificialmente temperatura, presión y tiempo. La geometría del fermentador es muy importante pero se define solamente en la fase de diseño y no es posteriormente modificable.
El metabolismo que se induce es muy complejo y da lugar a la producción de más de un centenar de metabolitos, entre ellos alcoholes superiores, ácidos superiores y cetonas.
Algunos productos son intermedios como las cetonas y se produce una transformación enzimática posterior. Otros como los alcoholes y los ácidos, reaccionan químicamente para formar una gama de aldehídos que producen los flavores afrutados y florales.
EL HONGO DE LA CERVEZA:
Son varios los géneros de hongos que se utilizan para fabricar cerveza: Saccharomyces, Torulaspora, Debaryomyces, Candida y Brettanomyces.
Las cervezas de fermentación espontánea usan especies de los géneros citados.
Las cervezas tipo Ale utilizan Saccharomyces cerevisiae y Torulaspora delbrueckii.
En la fabricación de la cerveza lager base de mi experiencia se utiliza el Saccharomyces uvarum. (Antigua denominación carlbergensis).
Reino: Fungi
División: Ascomycota
Clase: Hemiascomycetes
Orden: Saccharomycetales
Familia: Saccharomycetaceae
Género: Saccharomyces
Especie: Uvarum
LA DIFÍCIL CLASIFICACIÓN
En 1838 Mayen nombró por primera vez al Saccharomyces cerevisiae como un microorganismo que fermentaba el mosto de malta.
Emil Hansen en 1883 trabajando para la cervecería Carlsberg encontró dos cepas de fermentación baja que denominó Saccharomyces carlbergensis 1 y 2.
Desde el punto de vista industrial, la clasificación de este hongo no ha tenido demasiadas controversias. Sí las tuvo desde el punto de vista genético.
Hay que tener en cuenta que la clasificación industrial utiliza como base la asimilación y fermentación de especies químicas como claves.
A pesar de que M.W. Beijerinck en 1898 aseguró que S. uvarum y S. bayanus eran la misma especie, en toda la bibiografía posterior se contradice esta clasificación.
En en 1931 N.M. Stelling (Die sporangenen hefe) clasificó la cepa 1 como Saccharomyces carlbergensis Hansen y la segunda como Saccharomyces carlbergensis monacensis Dekker. En este momento la diferenciación era aún morfológica.
En 1935 R. Laneau (Bulletin Ancien École Brasserie de Louvain) utilizó suero de conejo para distinguir la especie cerevisiae de la carlbergensis.
En 1962 Joseph Vermeylren (Traité de la fabrication du malt et de la bière) reconocía la gran confusión existente en la clasificación de levaduras. Él utilizaba ya un método químico fisiológico, pues consideraba la especie cerevisiae la que no era capaz de fermentar raffinosa y carlbergensis a la especie que es capaz de producir glucosa y melibiosa a partir de la fermentación de raffinosa.
Un gran avance se produjo en 1952 con la publicación por J. Lodder y N.J.W. Kreger Van Rij de The Yeast. La primera clasificación sistemática.
Agrupaba a las levaduras en tres familias: Endomycetaceae, Sporobolomycetaceae y Crypcoccaceae.
La clasificación se basaba tanto en forma como en dos caracteres fisiológicos: asimilación y fermentación. La especie uvarum era considerada como existente.
En 1959, J. Haboucha, Ch. A. Masschelein y A. Devreux (Congreso EBC de Roma) definieron una nueva característica fisiológica: La especie cerevisiae tienen succinato oxidasa y no la carlbergensis. Por este motivo son más fácil asimilativas.
En 1962 Jan de Clerk (Cours de Brasserie) continuaba reconociendo que las levaduras no constituían todavía un grupo bien definido taxonómicamente repartido en diferentes clases. La diferenciación entre la especie cerevisiae y la carlbergensis continuaba siendo por tener esta última las enzimas raffinasa y melibiasa.
En 1971 W.P.K. Findlay (Modern Brewing Technology) añadía una nueva diferenciación entre ambas especies: La carlbergensis fermenta gliceraldehído.
En 1971 J.H. Hough, D.E. Briggs y R. Stevens (Malting and Brewing Sciencie) hacen un nuevo esfuerzo para la clasificación reconociendo que algunas asunciones son un tanto libres.
En el reino Fungi reconoce dos Filum: Anascosporogenus y Ascosporogenus.
En el Filum Ascosporogenus reconoce cuatro clases: Phycomycetes, Ascomycetes, Basidiomycetes y Fungi imperfecti.
Reconocen la carlbergensis como especie y dan un enorme impulso a la clasificación via fisiológica y química.
Por primera vez se inicia un trabajo de análisis genético conducente a la clasificación. Publican un mapa genético de Saccharomyces cerevisiae.
Estos trabajos inician un nuevo camino que inicialmente producirá problemas en la clasificación. Significan el paso de lo macroscópico a lo microscópico y por tanto un cambio de criterio.
Durante los años siguientes se produce una enorme confusión entre las especies. Unos investigadores consideran como sinónimos las especies carlbergensis, uvarum y pastorianus y unas veces la consideran como un híbrido de S. bayanus – S. cerevisiae, mientras otras veces la consideran un híbrido de S. cerevisiae y S. monacensis.
Otros investigadores como Casaregola, Nguyen, Lapathitis, Koyt y Gaillardin, llegan a considerar el S. uvarum como un sinónimo de S. bayanus ancestro producido por divergencia y al S. pastorianus como un híbrido de S. bayanus ancestro - S. cerevisiae.
Consideramos estas situaciones producidas por el estudio parcial de fragmentos del genoma.
Finalmente a partir del año 2000 mediante el estudio completo del genoma, empiezan a aclararse las situaciones y se producen repetidos acuerdos entre los especialistas.
Autores que no citamos por no permitirlo el Copyright (¡Qué diferencia con Hansen y Carlsberg que ni siquiera registraron el hallazgo de su S. carlbergensis, para ceder este trabajo a la humanidad!) encontraron la consistencia de la especie uvarum y curiosamente la procedencia de la especie bayanus de la hibridación de S. cerevisiae y S. uvarum.
En 2005 H. Nguyen y C. Gaillardin publicaron un trabajo en el que demostraron que el S. uvarum es una especie independiente y que S. bayanus es un híbrido de S. uvarum y S. cerevisiae.
En 2006 mediante técnicas de PCR - restricción se mantuvo como especie pura tanto S. uvarum como C. bayanus y se encontraron híbridos dobles de S.bayanus-S.cerevisiae, también de S. bayanus-S. uvarum e incluso híbridos triples de S. cerevisiae-S. bayanus-S. uvarum.
CONCLUSIÓN
Cuando se incrementa el detalle se hace difusa la clasificación. ¿No suena esto al principio de incertidumbre formulado por Werner Heisemberg en 1927, que nos dice que no podemos medir simultáneamente y con infinita precisión un par de magnitudes conjugadas?
Realmente no estamos tratando de magnitudes conjugadas, pero sí estamos haciendo alusión a un fenómeno parecido, en el campo de lo unicelular-pluricelular, al que Heisemberg enunció para diferenciar la macrofísica y la microfísica.
Hecha la panorámica de la clasificación de la especie de trabajo, es mejor retornar a las condiciones industriales para continuar el trabajo.
LA CARACTERIZACIÓN
Aún sabiendo que actualmente la clasificación segura es mediante el genoma, no es adecuado este procedimiento nada más que para los centros de investigación.
En un laboratorio típico de una industria se suele partir de una cepa pura adquirida en un banco de levaduras.
Para el trabajo de caracterización posterior se utilizan medios macroscópicos que se describirán.
EL GÉNERO
Una vez aislada una célula mediante extensión en agar malta, es fácil caracterizar el género Saccharomyces pues son células redondas u ovales que no forman películas en los medios líquidos, forman esporas redondas u ovales en número de 1 a 4, que no se separan fácilmente del asca. Reproducción vegetativa por gemación multilateral. Fermentan fuertemente glucosa, no asimilan glucosa al 1% vía aeróbica, no crecen en nitratos.
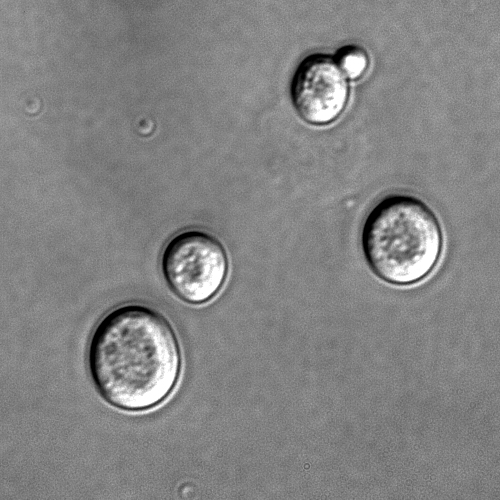
LA ESPECIE UVARUM
Hay varias llaves para caracterizar la especie. Las mejores son la de Lodder y la de Gilliland.
Método de Lodder:
Crecimiento en extracto de malta:
Tras 3 días a 25º C las células aparecen redondas u ovales. Simples o pareadas.
Miden (5-10) X (5-13) micras.
Después de 3 días sedimentan.
Después de 17 días forman anillo. |
Crecimiento en agar malta:
Tras 3 días a 25º C las células aparecen redondas u ovales. Simples o pareadas.
Miden (3,5-8) X (5,5-13) micras.
A los 17 días la colonia tiene color crema y brillo apagado. Forma plana.
Al microscopio no aparece pseudomicelio. |
Esporulación:
Fermentación:
Glucosa: +
Maltosa: +
Galactosa: +
Sacarosa: +
Raffinosa: + (Completa)
Lactosa: - |
Asimilación:
Glucosa: +
Maltosa: +
Galactosa: +
Sacarosa: +
Lactosa: - |
Asimilación de nitrato potásico:
Etanol como única fuente de carbono:
Escisión de arbutina:
Método de Gilliland:
Fermentación:
Glucosa: +
Maltosa: +
Galactosa: +
Sacarosa: +
Raffinosa: +
Melibiosa: + |
Conjugación de esporas:
Crecimiento en actidiona:
Como puede verse, el método de Gilliland, una vez conocido el género, es más sencillo. Pero el método de Lodder permite la clasificación sin conocer el género.
LA REPRODUCCIÓN
La reproducción del S. uvarum tiene características verdaderamente interesantes:
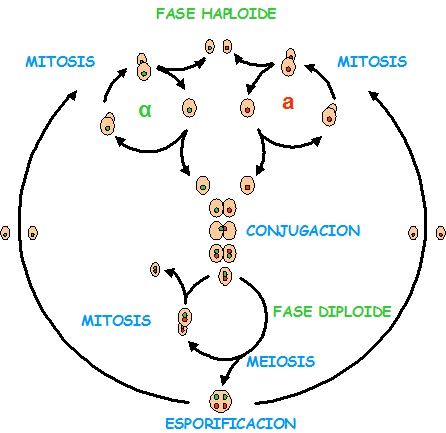
Como podemos ver se multiplican por mitosis (gemación) tanto las células haploides como las diploides.
En condiciones severas esporifica y cuando las condiciones son adecuadas las esporas inician ciclos de división como haploides. (En cepas industriales es muy difícil observar esporificación).
REPRODUCCIÓN SEXUAL
La reproducción sexual es muy interesante:
El sexo de una célula viene definido en el cromosoma 3 por un locus llamado MAT.
Unas células haploides llevan el locus MAT α y otras tienen el locus MAT a.
A la izquierda del MAT existe una copia MAT α silenciada llamada HML.
A la derecha del MAT existe una copia MAT a silenciada llamada HMR.
Las células a transcriben:
Los genes que producen el factor a.
Los genes que producen un receptor de membrana llamado Ste2p. |
Las células a reprimen:
Los genes que producen el factor α.
Los genes que producen un receptor de membrana llamado Ste3p. |
Las células α transcriben:
Los genes que producen el factor α.
Los genes que producen un receptor de membrana llamado Ste3p. |
Las células α reprimen:
Los genes que producen el factor a.
Los genes que producen un receptor de membrana llamado Ste2p. |
Como resultado, existen células a que producen la feromona “Factor a” y células α que producen la feromona “Factor α”.
Cuando se acerca una célula α a una célula a, ambas producen una protuberancia en la dirección de la feromona opuesta y se produce una conjugación formándose dos células diploides.
Las células diploides ya no responden a ninguna de las feromonas ya que sus alelos tienen los dos loci.
EL CAMBIO DE SEXO
Cuando una célula pasa varias generaciones sin la presencia de la hormona contraria, un gen llamado HO produce una endonuclaeasa que produce un corte en el locus MAT.
A continuación unas exonucleasas reparan el ADN de manera direccional realizando una copia de HML (α) si el MAT era a, o del HMR (a) si el MAT era α.
Al final del proceso la célula ha cambiado de sexo.
Hay que advertir que afortunadamente en las levaduras de cultivo industrial no se producen con facilidad estos fenómenos debido a alteraciones del gen HO.
LA SELECCIÓN DE LA ESPECIE
Normalmente un cervecero no tiene que elegir con qué género y especie de hongo va a trabajar a no ser que se construya una nueva cervecería.
Si así fuera, tendría primeramente que decidir si fabricará un cerveza ALE, LAGER, WEISSEN, LAMBIC u otra.
Lo corriente es trabajar en una industria que ya tiene definido su tipo de cerveza y por lo tanto su hongo.
En mi caso he trabajado durante 30 años con el Saccharomyces uvarum 34/70 WY mantenida como cepa pura en un banco de levaduras de Weinstephan (Freising- Baviera).
Las características industriales que interesan en el comportamiento de la levadura son:
1. Elevada capacidad de multiplicación.
2. Alta resistencia a la degeneración.
3. Elevada floculación.
4. Alto poder fermentativo.
5. Baja producción de cetonas.
6. Resistencia al alcohol.
7. Gama de alcoholes y ácidos producidos. |
1. CAPACIDAD DE MULTIPLICACIÓN
La velocidad de multiplicación es clave para que la transformación del mosto en cerveza se realice en el menor tiempo posible ya que los fermentadores, que suelen tener una capacidad de 2.500.000 a 5.000.000 de litros son muy caros y es importante que el tiempo de residencia en el reactor se acorte para que la producción se incremente.
Se inocula al mosto entre 5 y 10 millones de células por mililitro y se espera que al final de la fermentación dispongamos de 50 X 106.
Deberemos de seleccionar cepas que produzcan el mayor número posible de descendencia.
Para medirla se usa el hematocrito.
2. RESISTENCIA A LA DEGENERACIÓN
Los sucesivos ciclos de asimilación producen un envejecimiento prematuro de las mitocondrias y las células mueren. Esto tiene dos inconvenientes: Por un lado desciende la multiplicación y se alarga el ciclo. Por otro lado, las células muertas se autolisan y cambian los sabores de la cerveza.
Por este motivo se seleccionan cepas de baja mortalidad.
Para medirla se usa un hematocrito y una tinción al azul de metileno. Las células muertas se contabilizan por ser azules.
3. ELEVADA FLOCULACIÓN
Terminada la fermentación es interesante que las células floculen rápidamente porque se favorece la filtración y se mejora la cosecha para una siembra.
Existen cepas de levaduras que se vuelven pulverulentas y no floculan correctamente. Hay que seleccionar cepas floculentas.
Se mide mediante el método fotométrico de Umeda y Taguchi.
4. ALTO PODER FERMENTATIVO
Se necesita que la levadura metabolice rápidamente la mayor cantidad de azúcares posible. El motivo es por una parte para conseguir cervezas menos dulces y con menor valor energético. Por otra parte para evitar el crecimiento de células en la botella al no existir producto asimilable.
La atenuación límite de una cepa se mide haciendo fermentar un mosto de la industria de manera forzada en condiciones estándar de agitación y temperatura y midiendo el mínimo de la curva de extracto residual. La razón es que la curva sube cuando las células que ya no tienen alimento para fermentar, se autolisan.
5. BAJA PRODUCCIÓN DE CETONAS
Las levaduras producen inicialmente diacetilo y acetoina de sabor desagradable, y en la fase final de la fermentación las eliminan en parte.
Se buscan cepas que sean capaces de eliminar al límite estos metabolitos.
Se mide por análisis químico del diacetilo y acetoina residual.
6. RESISTENCIA AL ALCOHOL
El grado alcohólico del sustrato va aumentando a lo largo del proceso de fermentación. El alcohol producido es inhibidor del metabolismo de las células.
Se necesitan cepas que sean capaces de continuar su metabolismo a mayores concentraciones de alcohol para que el ciclo se acorte.
Se controla mediante el control de la atenuación en mostos adicionados de alcohol.
7. ALCOHOLES Y ÁCIDOS PRODUCIDOS
Cada cerveza tiene un perfil organoléptico que define su calidad gustativa. Se utilizan dos métodos para definir el perfil: Grupo de catadores profesionales existentes en las fábricas y análisis químico instrumental.
Se buscan cepas que tengan acentuada la producción de las especies químicas que definen nuestra cerveza.
Las levaduras se hayan sometidas a varios procesos anómalos:
- Mutaciones.
- Infecciones por levaduras salvajes.
- Degeneraciones.
- Infecciones por bacteria.
- Cepas killers.
Consiguientemente se necesita mantener las características de la cepa utilizada y buscar variedades con mejores propiedades.
Para mantener la cepa lo que se hace es eliminar las levaduras después de usarlas 4 o 5 veces. Por ello es preciso partir de una colonia testada en un banco de levaduras y periódicamente iniciar una propagación. Algunas empresas disponen de su propio departamento de mantenimiento de cepa pura.
Para buscar cepas mejoradas se parte siempre de la cepa en uso. Mediante micromanipulador o mediante extensión en placa Petri.
Se seleccionan varias colonias y se someten a la comprobación de la especie por un método rápido de los ya descritos.
Seguidamente se eliminan las cepas cuyo genotipo no sea consistente en pruebas de electroforesis. Es decir se eliminan híbridos y continuamos con clones puros haploides.
A continuación se someten estos clones a las 7 pruebas tecnológicas descritas.
Si alguno de los clones tiene mejores resultados que la cepa usada, se procede a una propagación y se sustituye.
Este proceso de selección se realiza permanentemente.
INDUCCIÓN DE CONDICIONES DE PRODUCCIÓN
Al principio decíamos que la domesticación de los seres vivos se valía tanto al cruce y selección como de la inducción de condiciones de vida que produzcan resultados deseables por el hombre aunque no sean las condiciones de vida estándar de organismo domesticado.
Los hongos domésticos son sometidos a condiciones extremas de vida con la intención de obligarlos a realizar transformaciones no habituales pero que producen los resultados aprovechables.
Nuestro Saccharomyces uvarum se alimentaría en la naturaleza mediante una vía asimilativa si no fuera porque limitamos el oxígeno en el medio a 8 p.p.m. De esta forma se produce una fuerte multiplicación hasta que el oxígeno se agota. A partir de ahí lo obligamos a producir alcohol por vía fermentativa hasta el límite en que el propio alcohol producido y la ausencia de alimento, paralizan su actividad y flocula.
Normalmente las células tienen su óptimo de metabolismo a 35 ºC. Nosotros obligamos a vivir a nuestra cepa a unas temperaturas entre 15 ºC y 2 ºC. Así evitamos la producción excesiva de ácidos superiores y alcoholes superiores que perjudicarían el aroma del producto final.
Igualmente mantenemos las temperaturas justo en el punto que obligamos al metabolismo a reducir las cetonas.
Conservamos la levadura en condiciones extremas de baja temperatura (1º C) para no permitirles el metabolismo durante el almacenamiento ya que la falta de alimento daría lugar a alimentarse con los productos resultantes de la autolisis de las células muertas.
Lo normal es vivir bao la presión atmosférica, nosotros sometemos al hongo a una sobrepresión al objeto de limitar la producción de productos volátiles y disolver el anhídrido carbónico resultante del metabolismo. Este carbónico constituye un elemento fundamental en las características organolépticas de la cerveza.
CONCLUSIÓN
El camino para la mejora genética y tecnológica de los hongos domésticos es ilimitado.
Nada evitará que se incremente el procedimiento de la manipulación genética de los hongos unicelulares para el aprovechamiento industrial.
No obstante apostamos por las técnicas clásicas que han demostrado ser económicas, productivas y fiables. Además de ser capaces de innovación tecnológica y progreso.

